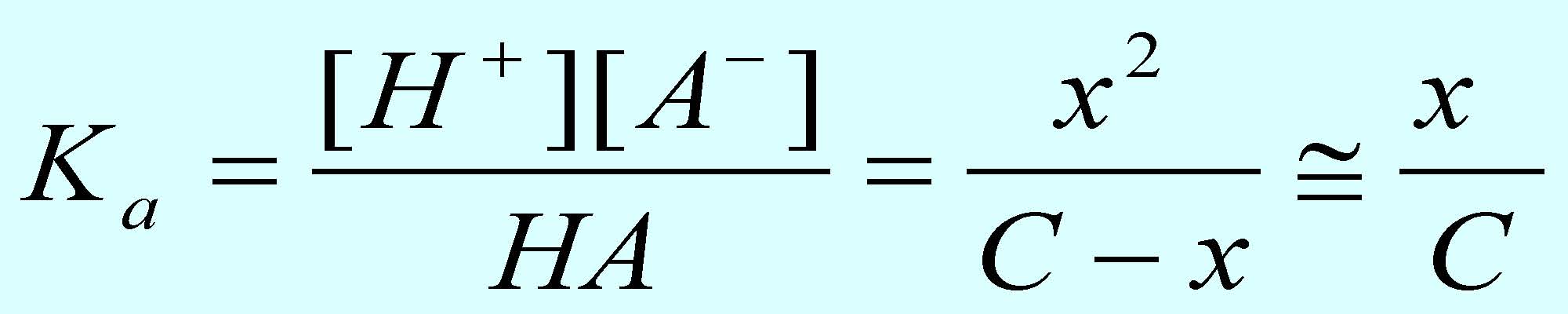Σταμάτης Χ. Μπογιατζής
Επίκουρος Καθηγητής
Εκπαιδευτικό Υλικό
Γενική και Ανόργανη Χημεία
Εργαστηριακό Μάθημα
Ακαδημαϊκό έτος 2012 - 2013 [Χειμερινό Εξάμηνο]
Α' εξάμηνο σπουδών
Το εργαστηριακό μάθημα θα γίνεται κάθε Τρίτη 14:00 - 16:00 και 16:00 - 18:00 και Τετάρτη 8:30-10:30, 14:30-16:30 και 16:30-18:30 στο Εργαστήριο Χημείας του Γεν. Τμήματος Χημείας.
Διδάσκοντες: Στ. Μπογιατζής και Γ. Φακορέλλης.
’σκηση 6 και 7: Οξεοβασικές ογκομετρήσεις
Στόχος: ζητείται από τους σπουδαστές να κατανοήσουν τα ιδιαίτερα χαρακτηριστικά των ισχυρών και ασθενών οξέων και βάσεων και να υπολογίζουν τις σταθερές Ka, Kb, pKa, pKb. Επίσης ζητείται η κατανόηση της αντίδρασης εξουδετέρωσης, της ογκομέτρησης, του ισοδύναμου και του τελικού σημείου.
Σημ: Να μην συγχέεται το ασθενές οξύ ή βάση με το ασθενώς όξινο διάλυμα ή ασθενώς αλκαλικό διάλυμα.
Μονοπρωτικά ασθενή και ισχυρά οξέα
Μονοπρωτικά είναι τα οξέα που στα υδατικά τους διαλύματα ελευθερώνεται ένα ιόν υδρογόνου (Η+) ή οξώνιο (Η3Ο+) από κάθε μόριό τους.
Ασθενές οξύ είναι εκείνο που διίσταται μερικώς (και όχι 100%) σε ιόντα οξωνίου (ή 'υδρογόνου', ή πρωτόνια) και ανιόντα.
π.χ. το νιτρώδες οξύ, και το οξικό οξύ είναι ασθενή οξέα (διίστανται μερικώς και συνεπώς το βέλος στην αντίδραση διάστασης είναι διπλό):
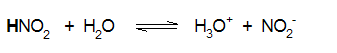 |
Ka=7.1x10-4 |
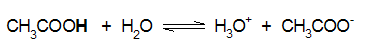 |
Ka=1.75x10-5 |
(με σκούρα γράμματα -bold- στο μόριο του οξέος σημειώνεται το υδρογόνο που ιονίζεται).
Οι τιμές των pKa στα δυο παραπάνω παραδείγματα υπολογίζονται ως εξής:
Για το νιτρώδες οξύ (HNO2): pKa = -log(Ka) = -log (7.1x10-4) = - (-3.15) = 3.15
Για το οξικό οξύ (CH3COOH): pKa = -log(Ka) = -log (1.75x10-5) = - (-4.75) = 4.75
Αντίθετα, το υδροχλωρικό, υδροβρωμικό και το υδροϊωδικό οξύ είναι ισχυρά οξέα (διίστανται πλήρως και συνεπώς το βέλος στην αντίδραση διάστασης είναι απλό):
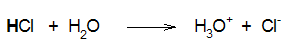 |
|
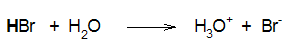 |
|
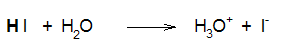 |
Αντίστοιχα ισχύουν και για τις βάσεις: οι ασθενείς βάσεις διίστανται μερικώς σε ιόντα υδροξειδίου και κατιόν, όπως π.χ. η αμμωνία:
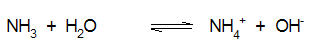 |
Kb=1.5x10-5 |
Ο βαθμός διάστασης (α) οξέων και βάσεων
Ένα οξύ, με το γενικό συμβολισμό ΗΑ διίσταται στο νερό ως εξής:
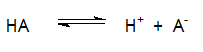 |
|
Ο βαθμός διάστασης (α) ενός οξέος ΗΑ εκφράζει το κλάσμα των μορίων ενός οξέος ή βάσης που βρίσκονται σε διάσταση σε σχέση με την ονομαστική του συγκέντρωση.
|
Βαθμός διάστασης: |
α= |
[Α-] |
= |
[Α-] |
| Cοξέος |
[ΗΑ]+[Α-] |
Στην περίπτωση ισχυρού οξέος ή βάσης, α = 1, ενώ στις περιπτώσεις ασθενών οξέων ή βάσεων, α <1. Κάποιες φορές, ο βαθμός διάστασης εκφράζεται επί τοις εκατό (%). Για παράδειγμα, εάν ένα ασθενές οξύ έχει βαθμό διάστασης α = 0.05, λέμε ότι διίσταται κατά 5%.
Η τιμή του βαθμού διάστασης α μπορεί να υπολογιστεί από τον παρακάτω τύπο, εάν γνωρίζουμε την τιμή του Ka (για οξύ).
|
Σταθερά διάστασης: |
|
όπου x=a/C |
Αντίστοιχη έκφραση για τη σταθερά Kb μπορούμε να καταστρώσουμε για ασθενή βάση.
Σημείωση: ενώ η σταθερά διάστασης του οξέος (Ka) είναι σταθερή ποσότητα (σε μια δεδομένη θερμοκρασία), ο βαθμός διάστασης α δεν είναι σταθερός: αυξάνεται, όσο μειώνεται η συγκέντρωση του ασθενούς οξέος. (βλ. και ερώτηση 3)
Διπρωτικά και τριπρωτικά οξέα
Διπρωτικά είναι τα οξέα που στα υδατικά τους διαλύματα ελευθερώνονται δύο ιόντα υδρογόνου (Η+) ή οξώνια (Η3Ο+) από κάθε μόριό τους. Αντίστοιχα, τριπρωτικά οξέα είναι εκείνα που ελευθερώνουν τρία ιόντα υδρογόνου (Η+) ή οξώνια (Η3Ο+) από κάθε μόριό τους.
Η διάστασή τους σε υδατικά διαλύματα γίνεται σταδιακά, δηλαδή πρώτα ελευθερώνεται το πρώτο ιόν οξωνίου (1η διάσταση) και στη συνέχεια το δεύτερο (2η διάσταση).
|
H2SO4
+
H2O
θειικό οξύ όξινο θειικό ανιόν |
1η διάσταση (ισχυρή), δηλαδή το θειικό οξύ ελευθερώνει (σχεδόν) κατά 100% ένα ιόν οξωνίου και όξινο θειικό ανιόν. Η ισορροπία είναι μετατοπισμένη πολύ προς τα δεξιά. |
|
HSO4- +
H2O
όξινο θειικό ανιόν θειικό ανιόν |
2η διάσταση (ασθενής), δηλαδή το όξινο θειικό ανιόν συμπεριφέρεται ως οξύ και ελευθερώνει ένα ιόν οξωνίου και το (ουδέτερο) θειικό ανιόν. Η ισορροπία είναι μετατοπισμένη προς τα αριστερά. |
Ογκομετρήσεις
Για τους υπολογισμούς που απαιτούνται στις ογκομετρήσεις είναι απαραίτητο να χρησιμοποιούμε τα greq (αντί για mol) και σε εκφράσεις συγκέντρωσης την κανονικότητα (Ν) αντί για τη μοριακότητα (Μ).
Όταν ένα διάλυμα οξέος εξουδετερώνεται πλήρως με ένα διάλυμα βάσης, τότε τα greq του οξέος είναι ίσα με τα greq της βάσης.
Δηλαδή,
gr-eq οξέος = gr-eq βάσης
ή
Νοξέος x Vοξέος = Νβάσης x Vβάσης
Η παραπάνω σχέση ισχύει τόσο για ισχυρά, όσο και για ασθενή οξέα. Αυτό που αλλάζει στις διάφορες περιπτώσεις ασθενών ή ισχυρών οξέων/βάσεων είναι το pH που αποκτά το διάλυμα μετά την εξουδετέρωση (στο τελικό σημείο της ογκομέτρησης).
Για παράδειγμα, όταν γίνεται ογκομέτρηση ασθενούς οξέος (π.χ οξικό οξύ) με ισχυρή βάση, στο τελικό σημείο όλο το οξύ έχει μετατραπεί στη συζυγή του βάση (CH3COONa).
CH3COOH + NaOH à CH3COONa + H2O
Δηλαδή, στο τελικό διάλυμα, δεν έχει περισσέψει καθόλου από το αρχικό οξύ (CH3COOH), ούτε από την αρχική βάση (NaOH). Απεναντίας, υπάρχει μόνο το προϊόν (CH3COONa) που συμπεριφέρεται σαν ασθενής βάση, η οποία σχηματίζει με το νερό ιόντα υδροξειδίου (ΟΗ-).
CH3COONa + H2O à CH3COOH + ΟΗ-
Συνεπώς το pH του διαλύματος εξαρτάται από την υδρόλυση της συζυγούς βάσης, και τη σταθερά διαστασής της που υπακούει στο νόμο:
Ka Kb = Kw
Περιπτώσεις ογκομέτρησης
1. Ογκομέτρηση ισχυρού οξέος με ισχυρή βάση (μέθοδος για να υπολογίζουμε πειραματικά την άγνωστη συγκέντρωση ισχυρής βάσης ή οξέος)
2. Ογκομέτρηση ασθενούς οξέος με ισχυρή βάση, π.χ. NaOH (μέθοδος για να υπολογίζουμε πειραματικά την άγνωστη συγκέντρωση ασθενούς οξέος)
3. Ογκομέτρηση ισχυρού οξέος με ασθενή βάση π.χ. HCl (μέθοδος για να υπολογίζουμε πειραματικά την άγνωστη συγκέντρωση ασθενούς βάσης)
Ερωτήσεις: (να χρησιμοποιήσετε όπου χρειάζεται, τις τιμές των σταθερών Ka και Kb του πίνακα που ακολουθεί):
1. Να υπολογιστεί ο βαθμός διάστασης (α) και το pH του υδατικού διαλύματος ενός ασθενούς οξέος ΗΑ συγκέντρωσης 0.0010Μ με Ka=1.00x10-4
2. Να υπολογιστεί ο βαθμός διάστασης (α) και το pH του υδατικού διαλύματος αμμωνίας (ασθενούς βάσης) συγκέντρωσης 0.0010Μ με Ka=1.50x10-5
3. Το οξικό οξύ (CH3COOH) έχει Ka=1.75x10-5. Παρασκευάζουμε μια σειρά διαλυμάτων του οξέος με συγκεντρώσεις 0.1, 0.01, 0.001 και 0.0001 Μ. Υπολογίστε το βαθμό διάστασης (α) και το pH σε κάθε περίπτωση. Στη συνέχεια, κατασκευάστε διαγράμματα του α και του pH συναρτήσει της συγκέντρωσης C του οξέος. Τί παρατηρείτε;
4. Ένα διάλυμα αμμωνίας (NH3) συγκέντρωσης 0.010 Μ είναι ιονισμένο κατά 4.3% (στους 25˚C). Να υπολογιστούν οι συγκεντρώσεις των ιόντων ΟΗ- και ΝΗ4+, καθώς και η σταθερά Kb της αμμωνίας.
5. Το οξικό οξύ (CH3COOH) έχει Ka =1.75 x 10-5. Να υπολογιστεί η σταθερά Kb του οξικού ανιόντος.
6. Η αμμωνία (NH3) έχει Kb=1.8 x 10-5. Να υπολογιστεί η σταθερά Ka του ανιόντος αμμωνίου (NH4+).
|
Σταθερές ιονισμού ασθενών οξέων |
|||
|
Οξύ |
Χημ. Τύπος |
Ka |
|
|
Οξικό οξύ |
CH3COOH |
1.7 x 10-5 |
|
|
Βενζοϊκό οξύ |
C6H3COOH |
6.3 x 10-5 |
|
|
Ανθρακικό οξύ |
H2CO3 |
4.3 x 10-7 |
|
|
HCO3- |
4.8 x 10-11 |
||
|
Μυρμηκικό οξύ |
HCHO2 |
1.7 x 10-4 |
|
|
Υδροκυανικό οξύ |
HCN |
4.9 x 10-10 |
|
|
Υδροφθορικό οξύ |
HF |
6.8 x 10-4 |
|
|
Θειικό οξύ |
H2SO4 |
- |
|
|
HSO4- |
1.1 x 10-2 |
||
|
Υδρόθειο |
H2S |
8.9 x 10-8 |
|
|
HS- |
1.2 x 10-13 |
||
|
Υποχλωριώδες οξύ |
HClO |
3.5 x 10-8 |
|
|
Νιτρώδες οξύ |
HNO2 |
4.5 x 10-4 |
|
|
Οξαλικό οξύ |
H2C2O4 |
5.6 x 10-2 |
|
|
HC2O4- |
5.1 x 10-5 |
||
|
H3PO4 |
6.9 x 10-3 |
||
|
Φωσφορικό οξύ |
H2PO4- |
6.2 x 10-8 |
|
|
HPO42- |
4.8 x 10-13 |
||
|
Σταθερές ιονισμού ασθενών βάσεων |
|||
|
Βάση |
Χημ. Τύπος |
Kb |
|
|
Αμμωνία |
NH3 |
1.8 x 10-5 |
|
|
Ανιλίνη |
C6H5NH2 |
4.2 x 10-10 |
|
|
Διμεθυλαμίνη |
(CH3)2NH |
5.1 x 10-4 |
|
|
Αιθυλαμίνη |
C2H5NH2 |
4.7 x 10-4 |
|
|
Υδραζίνη |
N2H4 |
1.7 x 10-6 |
|
|
Υδροξυλαμίνη |
NH2OH |
1.1 x 10-8 |
|
|
Μεθυλαμίνη |
CH3NH2 |
4.4 x 10-4 |
|